Протокол in silico дизайна модифицированных форм Сa2+-регулируемого фотопротеина беровина, активного в физиологических условиях
Моделирование структуры
Использование AlphaFold2 или ESMFold в реализации OpenFold, интегрированного в платформу, для предсказания различных конформационных состояний беровина без множественного выравнивания последовательностей. В качестве шаблона для первого цикла предсказания структуры используется структура акворина (PDB ID: 1EJ3). Веса для OpenFold - “model-2-ptm”. Количество циклов уточнения - 3.
Анализ субстрат-связывающего кармана
Наложение в PyMOL 2.0 пространственной модели апо-беровина на кристаллическую структуру акворина в комплексе с 2-гидропероксицелентеразином. Идентификация кластера полярных аминокислотных остатков, включая Lys90. Анализ водородных связей между Lys90 и боковой цепью Asn107. Данную процедуру анализа субстрат-связывающего кармана можно выполнить в PDBSiteScan.
Дизайн мутаций
Замена Lys90 на Met для создания гидрофобного окружения. Введение дополнительной мутации N107S для модификации сети водородных связей. Замена Trp103 на Phe для оптимизации взаимодействия с 6-(p-гидрокси)-фенильным заместителем целентеразина. Оценка стабильности мутантов Использование метрик достоверности pLDDT из OpenFold. Сравнение значений pLDDT в позициях 90, 107 и 103 между диким типом и мутантными структурами. Отбор мутаций с минимальным влиянием на стабильность белка.
Валидация модели
Сравнение предсказанной структуры с экспериментально определенной структурой беровина (PDB ID: 5BPJ). Анализ конформационных изменений в подвижных участках (остатки 142-167 и 183-193). Оценка расположения мутированных остатков относительно OH-группы 6-(p-гидрокси)-фенильного заместителя целентеразина. Оценка подвижности проводится в GROMACS.
Результаты моделирования
Тройной мутант K90M/W103F/N107S показат повышенный выход активного белка в физиологических условиях, сниженный уровень Ca2+-независимой люминесценции и более высокую устойчивость к фотоинактивации по сравнению с белком дикого типа (Рис. 1).
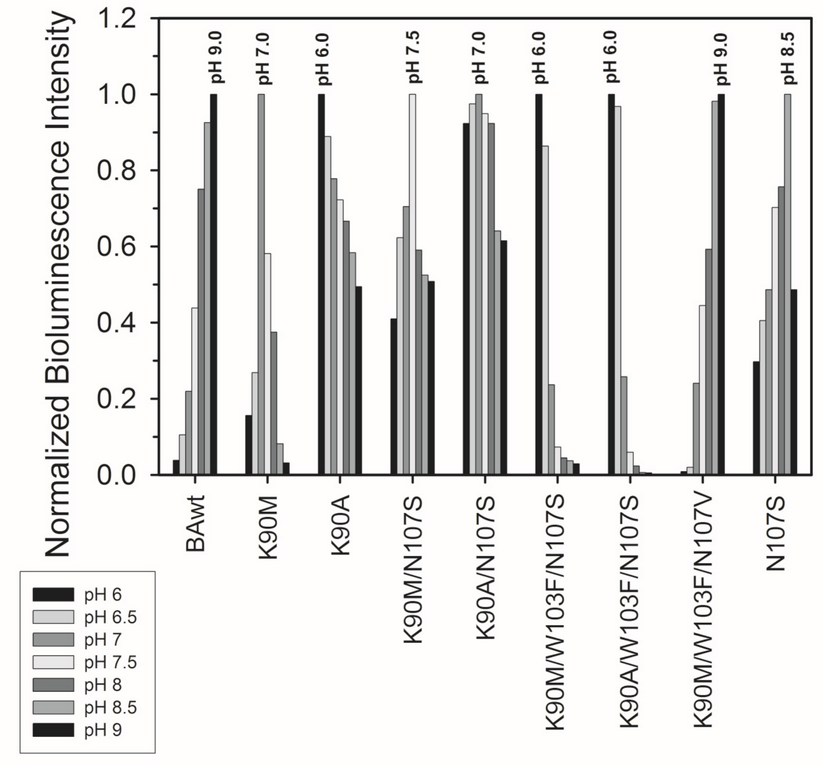
Рис.1. Нормализованные удельные биолюминесцентные активности беровина (BAwt) и мутантов после инкубации соответствующих апопротеинов с целентеразином (молярное соотношение целентеразин/апопротеин 5:1) при различных значениях pH с 0,5 M NaCl в течение 24 ч при +4 °C в темноте. Удельные активности при различных значениях pH были нормализованы к максимальной активности для каждого белка.