Вычислительный конвейер на основе ANDSystem, графовых нейронных сетей и методов молекулярного моделирования, для предсказания новых низкомолекулярных лигандов белков
ВВЕДЕНИЕ. Для реконструкции генных сетей часто применяют когнитивные системы автоматического анализа текстов научных публикаций и баз данных. В последние годы методы искусственного интеллекта, основанные на анализе гетерогенных графов биомедицинских сетей, получили широкое распространение для предсказания молекулярных взаимодействий. В частности, графовые нейронные сети (graph neural networks, GNN) позволяют эффективно выявлять отсутствующие ребра в генных сетях, таких как сети белок-белковых взаимодействий, ген–заболевание, лекарство–мишень и др., и тем самым предсказывать новые биологические связи. Одна из таких платформ, базирующаяся на методах искусственного интеллекта– ANDSystem, предназначенная для автоматического извлечения знаний о молекулярных взаимодействиях и на этой основе – реконструкции ассоциативных генных сетей. База знаний ANDSystem содержит сведения о более чем 100 млн взаимодействий между различными молекулярно-генетическими объектами (гены, белки, метаболиты, лекарства и др.). Взаимодействия представлены широким спектром типов: регуляторные связи, физические взаимодействия (белок–белок, белок–лиганд), каталитические и химические реакции, ассоциации между генами, фенотипами, заболеваниями и др. В настоящем исследовании на основе комплексного подхода, использующего: (а) нейронные сети с механизмом внимания, обученные на графе знаний ANDSystem и (б) метод молекулярного моделирования, были найдены лиганды, взаимодействующие с белком ORF3a. Белок ORF3a SARS-CoV-2 играет важную роль в патогенезе вируса за счет ион-канальной активности, индукции апоптоза и способности модулировать эндолизосомальные процессы и врожденный иммунитет хозяина. Поэтому найденные лигнады могут рассматриваться как новые молекулы – прототипы лекарств для терапии против вируса SARS-CoV-2. ОБЩЕЕ ОПИСАНИЕ КОНВЕЙЕРА. Вычислительный конвейер включал следующие этапы анализа (рисунок Ж.42): (1) применение ANDSystem для формирования графа знаний с узлами, соответствующими белкам, метаболитам, лекарствам, заболеваниям и другим объектам, а также рёбрами различных типов взаимодействий; (2) обучение графовой нейронной сети с механизмом внимания на графе знаний для генерации векторных представлений вершин; (3) построение нейросетевой модели для предсказания рёбер типа «белок–метаболит»; (4) скрининг потенциальных взаимодействий ORF3a с малыми молекулами с помощью графовой нейросети; (5) проведение молекулярного докинга (AutoDock Vina) и расчётов свободной энергии связывания методом MM/GBSA для отобранных кандидатов. Визуализация пространственных структур комплексов белок-лиганд осуществлялась с использованием ChimeraX и PyMOL.
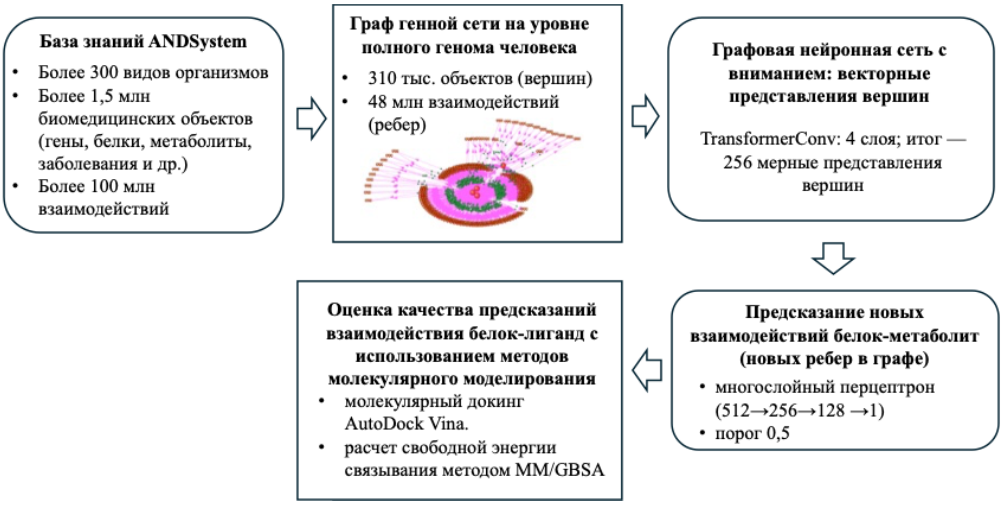
Рисунок Ж.42 – Общая схема вычислительного конвейера поиска новых низкомолекулярных лигандов белков, которые могут служить основой для конструирования новых лекарственных препаратов, с применением методов реконструкции генных сетей, графовых нейронных сетей и молекулярного моделирования
ДЕМОНСТРАЦИОННЫЙ ПРИМЕР. Разработанный подход применён к поиску новых лигандов вспомогательного белка ORF3a SARS-CoV-2, играющего значимую роль в патогенезе COVID-19 (ион-канальная активность, влияние на аутофагию и эндолизосомальный транспорт). В результате анализа ORF3a было выявлено пять новых кандидатов-лигандов, для которых докинг и расчёты MM/GBSA подтвердили возможность формирования стабильных комплексов (рисунок Ж.43). Биктегравир и 4-(бензоиламино)бензойная кислоты связываются с функциональной областью ORF3a, участвующей в связывании с белком человека VPS39 — субъединицей комплекса HOPS, который играет ключевую роль в слиянии аутофагосом и поздних эндосом с лизосомами. Оценки аффинности связывания у биктегравира по сравнению с 4-(бензоиламино)бензойной кислотой оказались более высокими (−7,37 ккал/моль по данным докинга; −14,71 ± 3,12 ккал/моль по MM/GBSA), что делает его перспективным кандидатом для репозиционирования в качестве ингибитора ORF3a. Таким образом, согласно данным компьютерного моделирования, взаимодействие биктегравира с ORF3a может нарушать связывание ORF3a с белком хозяина VPS39 и, как следствие, ослаблять блокаду HOPS-зависимого слияния аутофагосом и поздних эндосом с лизосомами. Среди выявленных лигандов особого внимания заслуживает биктегравир – зарегистрированный ингибитор интегразы ВИЧ, который может быть использован в репозиционировании как противоковидный лекарственный препарат, обладающий способностью нарушать опосредованную вирусом регуляцию процессов аутофагии и эндосомального транспорта в клетках.
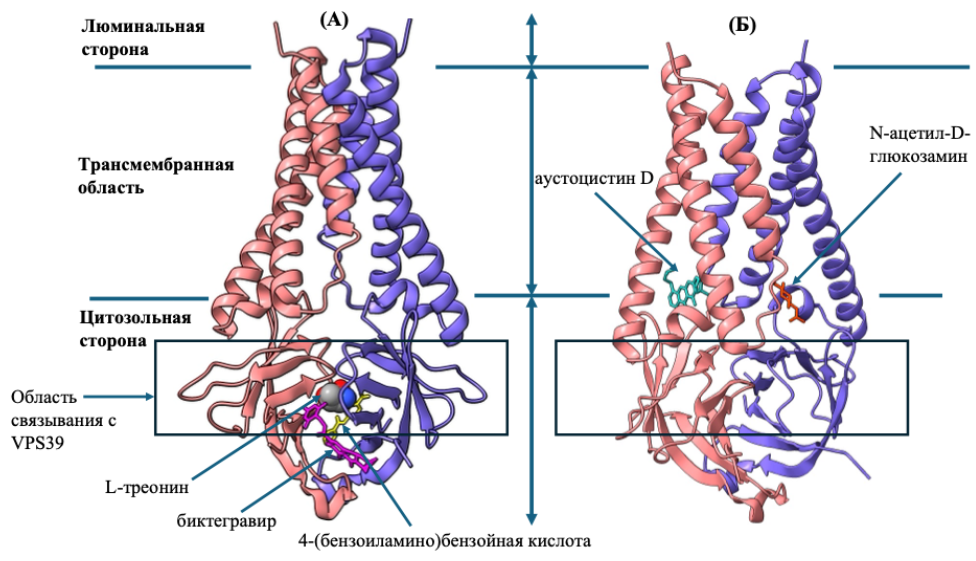
Рисунок Ж.43 – Пространственные структуры комплексов ORF3a с анализируемыми лигандами. (А) комплекс ORF3a с L-треонином, биктегравиром и 4-(бензоиламино)бензойной кислотой; (Б) комплекс ORF3a с аустоцистином D и N-ацетил-D-глюкозамином. Белок показан в ленточной модели; две субъединицы димера окрашены разными цветами. В панели (Б) структура белка повернута для более наглядного отображения лигандов. Лиганды показаны в палочковой модели (stick); их положения отмечены стрелками. L-треонин показан в шаровой модели (balls) для улучшения восприятия. Линиями обозначены участки белка, соответствующие его положению в мембране (Kern et al., 2021): цитозольная сторона, трансмембранная область и люминальная сторона (просвет аппарата Гольджи и эндо-/лизосом). Рамкой выделена область, участвующая во взаимодействии с белком VPS39. Изображения созданы в ChimeraX
ПУБЛИКАЦИЯ. Иванисенко Т.В., Деменков П.С., Клещев М.А., Иванисенко В.А. Предсказание взаимодействий белка ORF3a SARS-CoV-2 с низкомолекулярными лигандами с использованием когнитивной платформы ANDSystem, графовых нейронных сетей и молекулярного моделирования. Вавиловский журнал генетики и селекции. 2025;29(7):1084-1096. doi 10.18699/vjgb-25-113